Электролиз. Законы Фарадея
Дополнительно по теме
2 Электрическое поле
3 Постоянный электрический ток
- Закон Ома для участка цепи. Сопротивление проводников
- Последовательное и параллельное соединения проводников. Добавочные сопротивления и шунты
- Закон Ома для полной (замкнутой) цепи
- Последовательное и параллельное соединения источников тока. Правила Кирхгофа
4 Работа и мощность тока. Закон Джоуля - Ленца
6 Магнитное поле тока. Электромагнитная индукция
7 Переменный электрический ток
8 Электромагнитные колебания и волны
Электролиз. Законы Фарадея
1 Найти электрохимический эквивалент натрия. Молярная масса натрия m = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея ![]()
Решение:
![]()
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка ![]()
Решение:
![]()
3 Найти постоянную Фарадея, если при прохож-дении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
![]()
отсюда
![]()
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит No=NA/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
![]()
Следовательно, элементарный заряд
![]()
5 Молярная масса серебра m1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент ![]() . Найти электрохимический эквивалент золота к2, если молярная масса золота m2 = 0,197 кг/моль, его валентность z2 = 3.
. Найти электрохимический эквивалент золота к2, если молярная масса золота m2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
![]()
отсюда электрохимический эквивалент золота
![]()
Электролиз. Законы Фарадея
6 Найти массы веществ, выделившихся за время t=10ч на катодах трех электролитических ванн, вклю-ченных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiS04 и AgN03. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см . Электрохимические эквиваленты меди, никеля и серебра ![]()
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
![]()
7 При никелировании изделий в течение времени t = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля ![]() , его плотность
, его плотность ![]()
Решение:
![]()
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток Io=1,5А. Какую поправку надо внести в показание амперметра, если за время t=10мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди ![]() .
.
Решение:
По первому закону Фарадея m = kIt, где I-ток в цепи; отсюда I=m/kt=1,6 А, т.е. в показание амперметра надо внести поправку
![]()
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время t=5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра ![]() .
.
Решение:
По первому закону Фарадея m = klt, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kt= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
![]()
10 Для серебрения ложек через раствор соли серебра в течение времени t=5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра m = 0,108 кг/моль, его валентность z=1 и плотность ![]() .
.
Решение:
Толщина слоя
![]()
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда ![]() . Молярные массы железа и хлора
. Молярные массы железа и хлора ![]() .
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй - трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
![]()
во второй ванне
![]()
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
![]()
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода m = 0,001 кг/моль, его валентность z=1.
Решение:
![]()
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВтЧч/кг электроэнергии. Электрохимический эквивалент никеля ![]() . При каком напряжении производится электролиз?
. При каком напряжении производится электролиз?
Решение:
![]()
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВтЧч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки h=75%. Электрохимический эквивалент меди ![]() .
.
Решение:
К.п.д. установки
![]()
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
![]()
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время t=10с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди ![]() .
.
Решение:
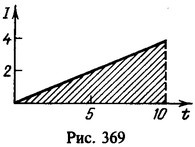 Средний ток
Средний ток
![]()
Заряд, протекший через раствор,
![]()
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
![]()
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время t=10ч. Э.д.с. поляризации e= 6 В. Электрохимический эквивалент меди ![]() .
.
Решение:
![]()
17 При электролизе воды через электролитическую ванну в течение времени t = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды m=0,018 кг/моль. Электрохимический эквивалент кислорода ![]() .
.
Решение:
![]()
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВтЧч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:
![]()
Дополнительно по теме
2 Электрическое поле
3 Постоянный электрический ток
- Закон Ома для участка цепи. Сопротивление проводников
- Последовательное и параллельное соединения проводников. Добавочные сопротивления и шунты
- Закон Ома для полной (замкнутой) цепи
- Последовательное и параллельное соединения источников тока. Правила Кирхгофа
4 Работа и мощность тока. Закон Джоуля - Ленца
6 Магнитное поле тока. Электромагнитная индукция
7 Переменный электрический ток
8 Электромагнитные колебания и волны

